सभी जानकारी आधुनिक आवर्त सारणी के बारे में All information about the Periodic Table –
आधुनिक आवर्त सारणी Periodic Table में कुल ज्ञात तत्व 118 है इनको व्यवस्थित करने का काम समय समय समय पर विभिन्न वैज्ञानिको द्वारा किया गया है जैसा कि हमने आवर्त सारणी के भाग-1 में देखा है कि इन तत्वो को व्यवस्थित करने में कितने वैज्ञानिको ने अपना योगदान दिया है । जैसा कि हम जानते है इन तत्वो को व्यवस्थित करने में सबसे अधिक सफल वैज्ञानिक मेंडलीफ थे। इन्होने जिस आवर्त सारणी को बनाया था उसी आवर्त सारणी पर आधुनिक आवर्त सारणी बेस है आवर्त सारणी के इस भाग में हम आगे देखेगें।
मोजले की आवर्त सारणी Periodic Table Mozley-
मोजले की आवर्ती सारणी को आधुनिक आवर्त सारणी कहते है इस आवर्त सारणी में अभितक ज्ञात 118 तत्वो को सामिल किया गया है। इनकी आवर्त सारणी के द्वारा यह पता चलता है कि तत्वो के भौतिक तथा रासायनिक गुण उनके परमाणु क्रमांक पर निर्भर करते है न कि परमाणु भार पर निर्भर करते है। इसलिए इन्होने आधुनिक आवर्तनियम प्रस्तुत किया ये नियम – तत्वों के भौतिक और रासायनिक गुण-धर्म, उनेक परमाणु क्रमांको के आवर्ती-फलन होते हैं।
इसका मतलब होतै है तत्वों के प्रमाणु क्रमांको के आधार पर व्यवस्थित किया जाय तो एक निश्चत् अंतराल के बाद समान गुण-धर्म वाले तत्वों की पुनरावृत्ति होती है।
आधुनिक आवर्त सारणी को को दीर्घाकार या प्रवर्धित आवर्त-सारणी कहते है।
आधुनिक आवर्त सारणी के विकास में मोजले के अलावा रैंग वर्नर तथा बरी का काफी योगदान रहा।
दीर्घाकार आवर्त सारणी Long Periodic Table-
यह आवर्त साणी मेण्डेलीफ आवर्त-सारणी का संशोधित रुप है ।
इस आवर्त सारणी के निर्माण का आधार तत्वों के गुणों का उनके इलेक्ट्रानिक विन्यास के बीच घनिष्ट सम्बन्ध है। इस आवर्त सारणी के विकास बोहर का काफी योगदान रहा है इसलिए इस आवर्त सारणी को बोहर की आवर्त-सारणी भी कहते है।
यह आवर्त सारणी तत्वो के बाहरी कक्षा में इलेक्ट्रानो के वितरण के सिद्धान्त के बाद उसके आधार पर बनाई गयी थी।
इनके अनुसार जिन तत्वो का इलेक्ट्रानिक विन्यास समान होते है उनके गुण भी समान होते है।
तत्वो को उनके बढ़ते परमाणु क्रमांक के क्रम में क्रमायोजित करने पर उनके इलेक्ट्रानिक विन्यासों में आवर्तिता पायी जाती है।
इस आवर्त सारणी में भी ऊर्ध्वाधर तथा क्षैतिज खान है जिन्हें क्रमशः वर्ग एवं आवर्त कहा जाता है।
इस आवर्त सारणी में हाइड्रोजन को उपवर्ग 1A तथा 7A दोनो वर्गो में सिरे पर रखा गया है । इससे दोनों वर्गो से हाइड्रोजन के सम्बन्ध का निर्देश होता है।
इस आवर्त सारणी में एक से लेकर कुल 7 आवर्त है।
समान इलेक्ट्रानिक विन्यास वाले तत्वों को एक साथ रखा गया है।
सभी A उपवर्गो के तत्व समान्य तत्व कहे जाते है।
इलेक्ट्रानिक विन्यास के आधार पर दीर्घाकार आवर्त-सारणी Long Periodic Table base on Elcetronic Configuration –
दीर्घा/-कार आवर्त-सारणी में तत्वों को उनके इलेक्ट्रॉनिक विन्यास के आधार पर तत्वो को चार भागो में विभाजित किया गया है।
| S Block | P Block | D Block | F Block |
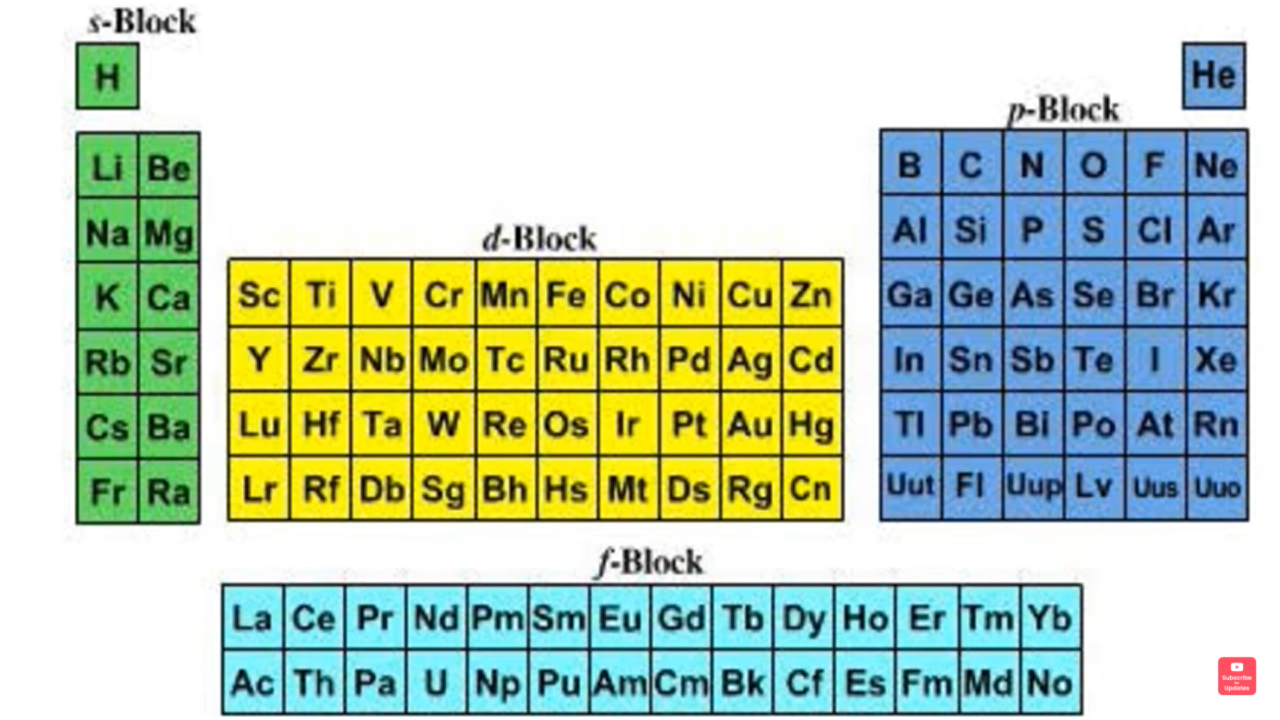
S,P,D,F Block –
S Block Element –
| H |
| Li | Be |
| Na | Mg |
| K | Ca |
| Rb | Sr |
| Cs | Ba |
| Fr | Ra |
S ब्लाक में वो तत्वो होते है जो ग्रुप 1 तथा 2 में होते है।
पहले वर्ग में उपस्थित तत्वो को क्षारीय धातु कहा जाता है। इसकी आक्सीकरण अवस्था +1 होता है।
दूसरे वर्ग में उपस्थित तत्वो को क्षारीय मृदा धातु कहा जाता है। इनकी आक्सीकरण अवस्था +2 होती है।
S ब्लाक के तत्वो का इलेक्ट्रानिक विन्यास nS1-2 होता है।
P Block Element-
| B | C | N | O | F | NE |
| Al | Si | P | S | Cl | Ar |
| Ga | Ge | As | Se | Br | Kr |
| In | Sn | Sb | Te | I | Xe |
| Tl | Pb | Bi | Po | At | Rn |
| Uut | Fl | Uup | Lv | Uus | Uuo |
आवर्त सारणी में 13 ग्रुप से लेकर 18 ग्रुप के तत्व P ब्लाक में आते है।
इन सभी तत्वो के बाह्तम इलेक्ट्रान P उपकोश में आते है।
इन सभी तत्वो के ब्राह्य कोश के S उपकोश में 2 और P उपकोश में एक से लेकर छः इलेक्ट्रान आते है। इस लिए इसको P ब्लाक के तत्व बोलते है।
P उपकोश में आने वाले तत्व धातु , अधातु, तथा उपधातु तीनो आते है।
हिलीयम का अंतिम इलेक्ट्रान S उपकोश में आता है फिर इस तत्व को P उपकोश के 18वें वर्ग में रखा गया है।
इस उपकोश में अक्रिय गैसो को स्थान दिया गया है।
P ब्लाक में कुल 37 तत्वो को स्थान दिया गया है।
इनके बाह्तम कोश का सामान्य इलेक्ट्रॉनिक विन्यास ns2, np1-6 होता है।
d Block Element-
वे तत्वो जिनका अंतिम इलेक्ट्रान d ब्लाक में आते है उनको डी ब्लाक के तत्व कहते है।
| Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn |
| Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd |
| La | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg |
| AC | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn |
वो सभी तत्वो जो 3 से लेकर 12 तक के ग्रुप में आते है वो सभी डी उपकोश में आते है।
इस उपकोश के तत्वो को संक्रमण तत्व भी कहा जाता है
d block के तत्वो का इलेक्ट्रानिक विन्यास (n-1)d1-10 ns0-2 होता है।
d block के तत्वो को s और p ब्लाक के तत्वो के बीच में रखा गया है।
d Block के सभी तत्व धात्विक प्रकृति के होते है और यह उष्मा व विद्युत के सुचालक होते है।
d ब्लाक के तत्वो का गलनांक एवं क्वथनांक उच्च होते है।
f block element-
| La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu |
| Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr |
इस ब्लाक के तत्वो को आंतरिक संक्रमण धातु भी कहा जाता है।
F BLOCK के तत्वो का इलेक्ट्रानिक कान्फीगेरेशन (n-2f(0-14)(n-1)d(0-1)ns2 होता है।
F BLOCK के तत्व दो पीरियड में होते है।
एक को लेन्थानाइड्स दूसरे को एक्टीनाइड कहा जाता है।
वे तत्व जो परमाणु संख्या 57 से शुरु होते है और 71 तक जाते है
उनको लेन्थानाइड्स और जो 90 से लेकर 103 तक जाते है उन्को एक्टीनाइड्स कहा जाता है ये सभी तत्व F ब्लाक में आते है।