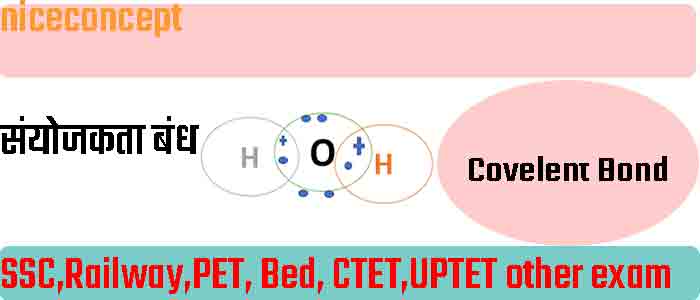
संयोजकता (sanyojakta ) Covalent Bond-
पृथ्वी उपस्थित सभी तत्व एक दूसरे से आकर्षित होते रहते है। यह आकर्षण ही उन्हे विभिन्नत तत्वो में बदलने का मौका देता है। जब यह तत्व एक दूसरे से अपने इलेक्ट्रानो का साझा करते है तो नये तत्व का निर्माण होता है इन इलेक्ट्रानो के शेयर को ही संयोजकता Covalent Bond कहते है यह विभिन्न प्रकार के होते है इन्ही बारे में हम इस भाग में बात करेगें। आइये जानते है
इस शब्द का प्रयोग सर्वप्रथम फ्रैंकलैण्ड ने किया था।
किसी भी तत्व की बाहरी कक्षा में उपस्थित इलेक्ट्रान की संख्या को संयोजकता कहते है
अथवा
तत्वो के परमाणुओं के परस्पर संयोजन करने की क्षमता को संयोजन कहा जाता है।
इन तत्वो को जिन रेखाओं द्वारा दिखाया जाता है उन रेखाओं को संयोजकता बंधन कहा जाता है।
यह तीन प्रकार का होता है।
1-वैद्युत संयोजकता Electric Covalent Bond-
जब दो परमाणु के बीच इलेक्ट्रानो के स्थानान्तरण के द्वारा जो बंध बनता है वैद्युत संयोजी बंध कहा जाता है।
इसमे त्यागने वाले तत्व पर धन आवेश तथा ग्रहण करने वाले तत्व पर ऋण आवेश आ जाता है जिस बल के द्वारा यह एक दूसरे से बंधे होते है उसे ही वैद्युत संयोजी बंध या आयनिक बंध कहते है।
उदाहरण-
NaCl सोडियम क्लोराइड में वैद्युत संयोजी बंध पाया जाता है क्योकि सोडियम के बाहरी कक्षा में 1 इलेक्ट्रान है और यह अपना एक इलेक्ट्रान त्यागना चाहता है
इसी तरह क्लोराइड के बाहरी कक्षा में 7 इलेक्ट्रान यह अपनी कक्षा में 8 इलेक्ट्रान पूरी करना चाहेगा।
जब इनका संयोजन होता है तब सोडियम अपना इलेक्ट्रान त्यागता है तथा क्लोरीन इलेक्ट्रान को ग्रहण करता है इस विधि को विद्युत संयोजन कहते है
सहसंयोजक बंध Covalent Bond –
दो समान या असमान परमाणुओं के बीच इलेक्ट्रॉन के साझेदारी से बनने वाली बंध को सहसंयोजक बंध कहते है
इन परमाणुओं के बीच संयोजक बंध बनने के लिए उनकी विद्युत ऋणात्मकता समान या लगभग समान होना चाहिए। ये विद्यु संयोजी यौगिको की तुलना में मृदु तथा कम भंगुर होते है।
संहसंयोजक बंध तीन प्रकार के होते है
एकल बंध Single Bond-
एकल बंध वह बंध होते है जो दो परमाणुओं के मध्य एक इलेक्ट्रॉन का साझा करते है तो बने हुए बंध एकल बंध कहलाते है।
द्वि आबंध Double Bond –
जब जो परमाणुओ के मध्य दो इलेक्ट्रान का साझा होता है तो इसे द्वि बंध कहते है।
त्रिआबंध Three Bond –
जब दो परमाणुओं के मध्य तीन इलेक्ट्रान युग्मों का साझा होता है। तो इस बन्ध को त्रिआबन्ध कहते है
उप-सहसंयोजकता (Co-ordination compound)-
उप-सहसंयोजकता उसे कहते है जब दो परमाणु के बीच असमानता के कारण बन्ध बनता है तो इसे उप-सहसंयोजकता कहते है
ऐसे तत्व जो इलेक्ट्रान का देता है उसे दाता कहा जाता है जो प्राप्त करता है उसे ग्राही कहा जाता है
जैसे-
NH4
N(2,5) और H(1)
इस स्ट्रकचर में नाइट्रोजन अपने बाहरी कोश को पुरा करने के लिए तीन इलेक्टॉन चाहता है जो 3 हाइड्रोजन से साझेदारी करके पूरा करता है लेकिन इस स्ट्रकचर में चार इलेक्ट्रान है। लेकिन नाइट्रोजन न चाहते हुए भी चौथे हाइड्रोजन से साझेदारी करता है। इस साझेदारी को उप-सहसंयोजी बंध कहते है
ऐसे यौगिक जिनमे उपसंहसंयोजी बंध होता है उनका परावैद्युत स्थरांक का मान उच्च होता है।